
STOIKIOMETRI merupakan salah satu konsep Krusial dalam kimia yang mempelajari Rekanan kuantitatif antara pereaksi dan produk dalam reaksi kimia.
Dengan memahami stoikiometri, kita dapat menghitung jumlah zat yang dibutuhkan atau dihasilkan dalam suatu reaksi kimia. Istilah ini berasal dari bahasa Yunani, Ialah “stoicheion” yang berarti elemen, dan “metron” yang berarti ukuran.
Konsep ini membantu kita Kepada mengukur dan memprediksi hasil reaksi kimia berdasarkan persamaan yang seimbang.
Konsep Dasar Stoikiometri
1. Persamaan Kimia Seimbang
Persamaan kimia menunjukkan bagaimana zat-zat berinteraksi dalam reaksi.
Setiap persamaan harus seimbang, artinya jumlah atom dari masing-masing unsur di sisi pereaksi (kiri) harus sama dengan jumlah atom di sisi produk (kanan).
Hal ini memastikan bahwa Kagak Terdapat atom yang hilang atau terbentuk secara Aneh.
Contohnya:
2H2+O2→2H2O
Dalam reaksi ini, Terdapat 4 atom hidrogen dan 2 atom oksigen di kedua sisi persamaan. Ini menunjukkan bahwa persamaan tersebut seimbang.
-
Mol dan Massa Mol
Mol adalah satuan Kepada menghitung jumlah partikel (atom atau molekul) dalam zat. Satu mol mengandung Kurang Lebih 6,022 × 10²³ partikel (bilangan Avogadro). Massa molar adalah massa satu mol dari suatu zat, yang Dapat ditemukan di tabel periodik. Misalnya, massa molar hidrogen (H) adalah 1 g/mol, dan oksigen (O) adalah 16 g/mol.
-
Konversi Antara Gram dan Mol
Rekanan antara massa dan mol dinyatakan dengan rumus:

Langkah-langkah Perhitungan Stoikiometri
Kepada melakukan perhitungan stoikiometri, langkah-langkah berikut Dapat diikuti:
1. Tulis Persamaan Kimia yang Seimbang
Mulailah dengan memastikan bahwa persamaan kimia yang diberikan sudah seimbang. Jumlah atom dari setiap unsur harus sama di kedua sisi.
2. Konversi Gram atau Volume ke Mol
Apabila yang diberikan adalah massa, ubah menjadi mol dengan menggunakan massa molar. Apabila yang diberikan adalah volume gas, gunakan Rekanan 1 mol = 22,4 liter pada STP (kondisi standar suhu dan tekanan).
3. Gunakan Rasio Mol dari Persamaan Kimia Seimbang
Dari persamaan kimia yang sudah seimbang, gunakan rasio mol Kepada menghitung berapa banyak produk yang dihasilkan atau berapa banyak pereaksi yang dibutuhkan.
4. Konversi Kembali ke Gram atau Volume
Setelah mendapatkan mol, Apabila diminta dalam gram atau volume, konversikan kembali ke satuan tersebut menggunakan massa molar atau Rekanan gas pada STP.
Teladan Perhitungan
Teladan soal: Berapa gram karbon dioksida (CO₂) yang dihasilkan Apabila 10 gram metana (CH₄) dibakar sempurna?
Langkah 1: Tuliskan persamaan kimia yang seimbang:
CH4+2O2→CO2+2H2O
Langkah 2: Hitung mol CH₄. Massa molar CH₄ = 16 g/mol.
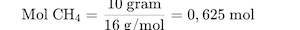
Langkah 3: Gunakan rasio mol.
Dari persamaan, 1 mol CH₄ menghasilkan 1 mol CO₂. Jadi, 0,625 mol CH₄ menghasilkan 0,625 mol CO₂.
Langkah 4: Hitung massa CO₂. Massa molar CO₂ = 44 g/mol.
Massa CO2=0,625 mol×44 g/mol=27,5 gram
Jadi, 10 gram metana akan menghasilkan 27,5 gram karbon dioksida.
Stoikiometri adalah keterampilan Krusial dalam kimia yang memungkinkan kita menghitung Rekanan kuantitatif antara zat-zat dalam reaksi kimia.
Dengan mengikuti langkah-langkah sistematis, kita dapat menentukan jumlah pereaksi dan produk yang terlibat dalam reaksi.
Kepada siswa SMA, memahami stoikiometri adalah dasar yang Krusial Kepada memahami topik-topik kimia yang lebih kompleks seperti termokimia, larutan, dan gas.
Tips Belajar Stoikiometri Kepada Siswa
- Selalu pastikan persamaan kimia yang digunakan sudah seimbang sebelum melakukan perhitungan.
- Pahami konsep mol dengan Bagus, karena ini adalah dasar dari kebanyakan perhitungan kimia.
- Latihan secara konsisten dengan berbagai soal Kepada meningkatkan keterampilan dalam menghitung stoikiometri.
Dengan menguasai stoikiometri, siswa akan lebih siap menghadapi tantangan soal kimia, Bagus dalam ujian maupun eksperimen laboratorium. (Z-10)
Sumber:
-
Petrucci, R. H., Herring, F. G., Madura, J. D., & Bissonnette, C. (2011). General Chemistry: Principles and Modern Applications. 10th Edition. Pearson Education.
-
Chang, R., & Goldsby, K. (2016). Chemistry. 12th Edition. McGraw-Hill Education.
-
Silberberg, M. S. (2013). Principles of General Chemistry. 3rd Edition. McGraw-Hill Education.
-
Brown, T. L., LeMay, H. E., Bursten, B. E., Murphy, C., & Woodward, P. (2014). Chemistry: The Central Science. 13th Edition. Pearson.




